I qPCR-eksperimenter er primerdesign også et meget vigtigt led.Om primerne er egnede eller ej er tæt forbundet med, om amplifikationseffektiviteten når standarden, om de amplificerede produkter er specifikke, og om de eksperimentelle resultater er tilgængelige.
Så hvordan gør man qPCR primer specificitet bedre?Høj forstærkningseffektivitet?
I dag vil vi tage dig med til at designe qPCR-primere sammen, og lade qPCR-primerdesign blive en effektiv viden i eksperimenter.
Når du designer qPCR-primere, skal du normalt være opmærksom på følgende punkter: primere skal designes på tværs af introner så meget som muligt, produktlængden skal være 100-300 bp, Tm-værdien skal være så tæt som muligt på 60°C, og opstrøms- og nedstrømsprimerne skal være så tæt på som muligt, og enden af primeren skal være G C eller primeren osv.
1. Design af primere, der spænder over introner
Når man designer qPCR-primere, kan valg af primere designet på tværs af introner forhindre gDNA-skabelonen i at blive amplificeret, og produkterne er alle afledt af amplifikationen af cDNA, hvilket eliminerer indflydelsen af gDNA-kontamination.
2. Primer længde
Primerlængden er generelt mellem 18-30 nt, og længden af amplifikationsproduktet bør kontrolleres mellem 100-300 bp så meget som muligt.
Hvis primeren er for kort, vil det føre til uspecifik amplifikation, og hvis den er for lang, vil den let danne sekundær struktur (såsom hårnålestruktur).Hvis amplifikationsproduktet er for langt, er det ikke egnet til polymerase-reaktion, hvilket vil påvirke effektiviteten af PCR-amplifikation.
3. GC indhold og Tm værdi
GC-indholdet i primere bør kontrolleres mellem 40% og 60%.Hvis det er for højt eller for lavt, er det ikke befordrende for at starte reaktionen.GC-indholdet i de fremadrettede og omvendte primere bør være tæt på det samme for at opnå den samme Tm-værdi og annealingstemperatur.
Tm-værdien bør så vidt muligt være mellem 55-65°C, generelt omkring 60°C, og Tm-værdien for opstrøms og nedstrøms bør være så tæt som muligt, helst ikke mere end 4°C.
4. Undgå at vælge A i 3′-enden af primeren
Når 3'-enden af primeren er mismatchet, er der store forskelle i synteseeffektiviteten af forskellige baser.Når den sidste base er A, kan den også initiere kædesyntese selv i tilfælde af mismatching, og når den sidste base er T When, reduceres effektiviteten af mismatchinduktion kraftigt.Prøv derfor at undgå at vælge A i 3′-enden af primeren, og det er bedre at vælge T.
Hvis det er en probe-primer, kan 5'-enden af proben ikke være G, fordi selv når en enkelt G-base er forbundet til FAM-fluorescensreportergruppen, kan G også slukke det fluorescerende signal, der udsendes af FAM-gruppen, hvilket resulterer i falske negative resultater.Komme til syne.
5. Grundfordeling
Fordelingen af de fire baser i primeren er fortrinsvis tilfældig, idet man undgår mere end 3 på hinanden følgende G eller C i 3'-enden og mere end 3 på hinanden følgendeG eller C er lette at generere parring i den GC-rige sekvensregion.
6. Primerdesignområdet bør undgå komplekse sekundære strukturer.
Den sekundære struktur, der dannes af den enkelte streng af amplifikationsproduktet, vil påvirke den jævne udvikling af PCR.Ved at forudsige, om der er en sekundær struktur i målsekvensen på forhånd, forsøg at undgå denne region i udformningen af primere.
7. Primerne selv og mellem primerne bør forsøge at undgå på hinanden følgende komplementære baser.
Der kan ikke være nogen konsekutiv 4 baser komplementaritet mellem selve primeren og primeren.Primeren i sig selv bør ikke have en komplementær sekvens, ellers vil den folde sig selv for at danne en hårnålestruktur, hvilket vil påvirke annealingskombinationen af primeren og skabelonen.
Komplementære sekvenser kan ikke eksistere mellem opstrøms- og nedstrømsprimere.Komplementaritet mellem primere vil producere primer-dimere, som vil reducere PCR-effektiviteten og endda påvirke kvantitativ nøjagtighed.Hvis primer-dimer- og hårnålestrukturerne er uundgåelige, bør △G-værdien ikke være for høj (bør være mindre end 4,5 kcal/mol).
8. Primerne amplificerer det målspecifikke produkt.
Det ultimative mål med qPCR-detektion er at forstå overfloden af målgenet.Hvis ikke-specifik amplifikation forekommer, vil kvantificeringen være unøjagtig.Derfor, efter at primerne er designet, skal de testes af BLAST, og produkternes specificitet sammenlignes i sekvensdatabasen.
Dernæst tager vi det humane GAS6 (Growth arrest specific 6) gen som et eksempel til at designe qPCR-primere.
01 forespørgselsgen
Homo GAS6gennem NCBI.Her bør vi være opmærksomme på at sammenligne gennavnet og arterne for at sikre, at de er konsistente.
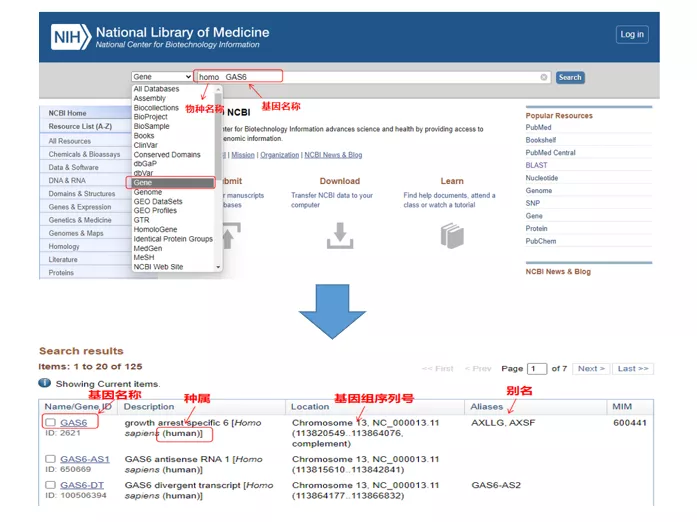 02 Find gensekvensen
02 Find gensekvensen
(1) Hvis målsekvensen er genomisk DNA, skal du vælge den første, som er genets genomiske DNA-sekvens.
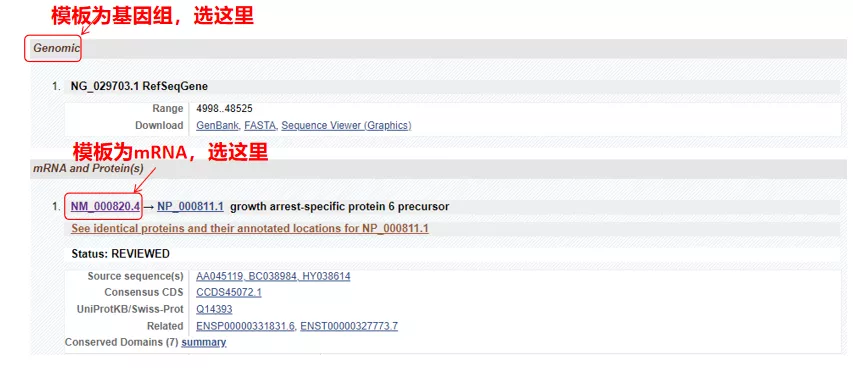 (2) Hvis målsekvensen er mRNA, skal du vælge den anden.Efter indtastning skal du klikke på "CDS" i tabellen nedenfor.Den brune baggrundssekvens er den kodende sekvens for genet.
(2) Hvis målsekvensen er mRNA, skal du vælge den anden.Efter indtastning skal du klikke på "CDS" i tabellen nedenfor.Den brune baggrundssekvens er den kodende sekvens for genet.
 03 Design primere
03 Design primere
Gå ind i Primer-BLAST-grænsefladen
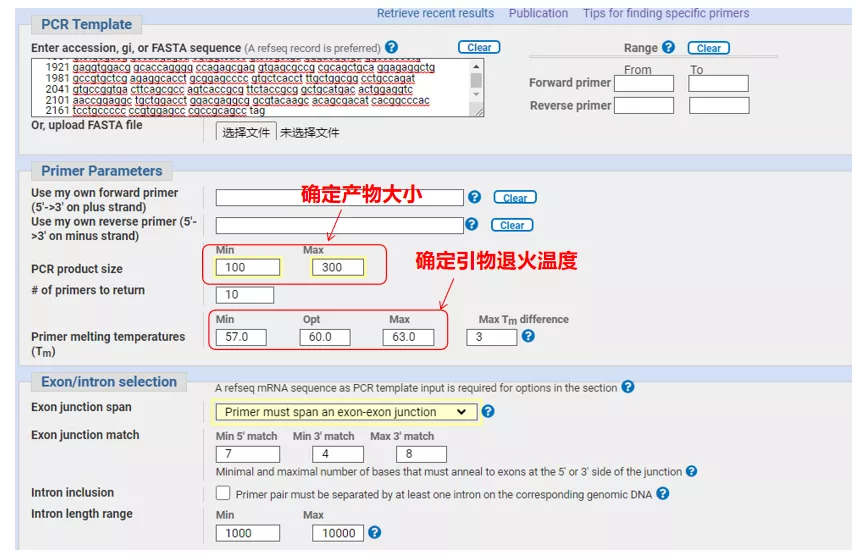
 Indtast gensekvensnummeret eller sekvensen i Fasta-format øverst til venstre, og udfyld de relevante parametre.
Indtast gensekvensnummeret eller sekvensen i Fasta-format øverst til venstre, og udfyld de relevante parametre.
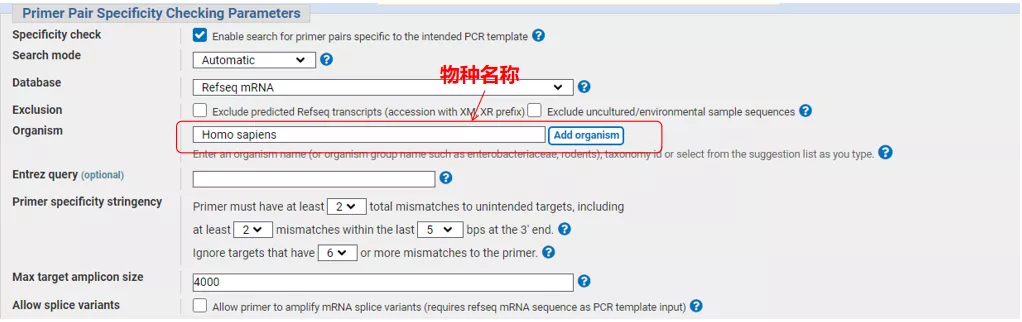
Klik på "Hent primere", og NCBI vil poppe op for at fortælle dig, at et sådant parametervalg vil blive forstærket til andre splejsningsvarianter.Vi kan tjekke de forskellige splejsningsvarianter og indsende dem for at få det passende primerpar (som vist i figuren nedenfor).Denne proces kan tage ti sekunder at køre.
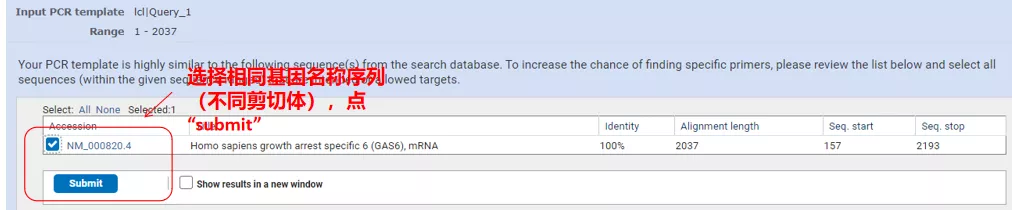
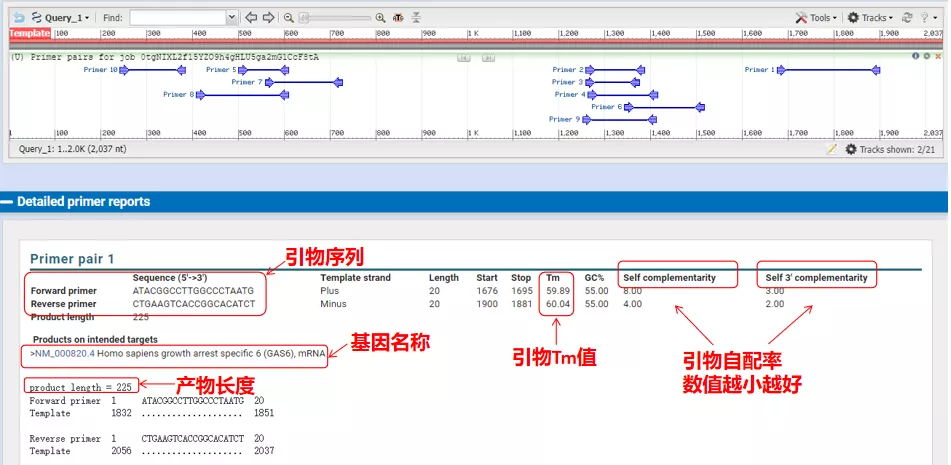 Udglødningstemperaturerne for disse primerpar er alle omkring 60°C.Vælg efter formålet med forsøget primere med moderat længde, god specificitet og mindre selvkomplementering af primerne til forsøget, og succesraten er ret høj!
Udglødningstemperaturerne for disse primerpar er alle omkring 60°C.Vælg efter formålet med forsøget primere med moderat længde, god specificitet og mindre selvkomplementering af primerne til forsøget, og succesraten er ret høj!
04Primer specificitet verifikation
Faktisk kan Primer-Blast, udover at designe primere, også evaluere de primere, vi selv har designet.Vend tilbage til primerdesignsiden, indtast de upstream- og downstream-primere, vi har designet, og andre parametre vil ikke blive justeret.Efter indsendelse kan du se, om parret af primere også findes på andre gener.Hvis alle af dem vises på genet, vi ønsker at amplificere, hvilket indikerer, at specificiteten af dette primerpar er stor!(Dette er f.eks. det eneste resultat af primer-forespørgslen!)
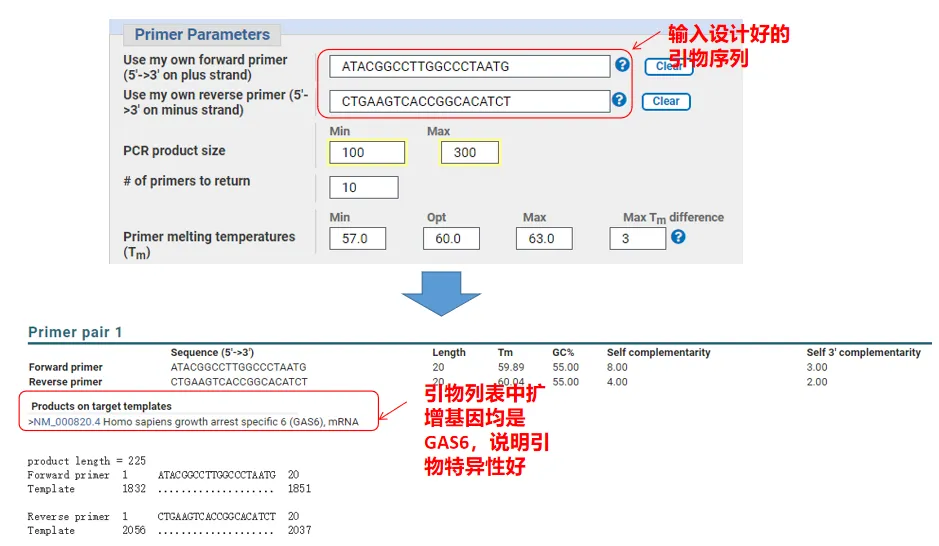
05 Primer kvalitetsbedømmelse
Hvilken slags primer er den "perfekte" primer, der kombinerer "amplifikationseffektivitet op til standard", "amplificerede produktegenskaber" og "pålidelige eksperimentelle resultater"?
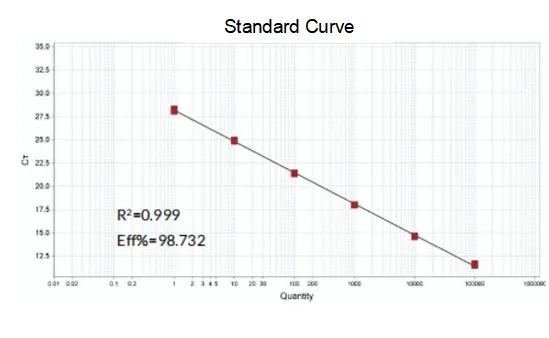 Forstærkningseffektivitet
Forstærkningseffektivitet
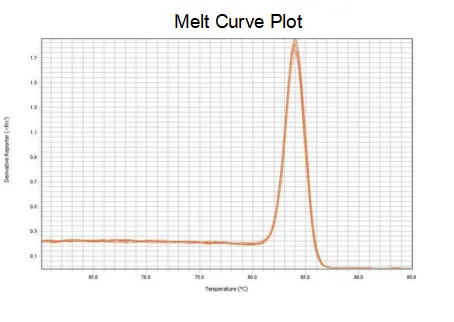 smeltekurve
smeltekurve
Amplifikationseffektiviteten af primerne når 90%-110%, hvilket betyder, at amplifikationseffektiviteten er god, og smeltekurven har en enkelt top og sædvanligvis Tm>80°C, hvilket betyder, at amplifikationsspecificiteten er god.
Relaterede produkter:
Real Time PCR Easy–SYBR GREEN I
Real Time PCR Easy-Taqman
Indlægstid: 10-feb-2023








