Antistoffer, også kaldet immunoglobuliner (Ig), er glykoproteiner, der specifikt binder til antigener.
Traditionelt antistofpræparat fremstilles ved at immunisere dyr og opsamle antiserum.Derfor indeholder antiserum normalt antistoffer mod andre ikke-relaterede antigener og andre proteinkomponenter i serumet.Generelle antigenmolekyler indeholder for det meste flere forskellige epitoper, så konventionelle antistoffer er også en blanding af antistoffer mod flere forskellige epitoper.Selv de konventionelle serumantistoffer rettet mod den samme epitop er stadig sammensat af heterogene antistoffer produceret af forskellige B-cellekloner.Derfor kaldes konventionelle serumantistoffer også polyklonale antistoffer, eller kort sagt polyklonale antistoffer.
Monoklonalt antistof (monoklonalt antistof) er et meget ensartet antistof produceret af en enkelt B-celle klon og kun rettet mod en specifik epitop.Det fremstilles sædvanligvis ved hybridomteknologi - hybridomantistofteknologi er baseret på cellefusionsteknologi, der kombinerer B-celler med evnen til at udskille specifikke antistoffer og myelomceller med uendelig vækstkapacitet til B-cellehybridomer.Denne hybridomcelle har karakteristika af en forældrecelle.Det kan formere sig på ubestemt tid og udødelig in vitro ligesom myelomceller, og det kan syntetisere og udskille specifikke antistoffer som miltlymfocytter.Gennem kloning kan en monoklonal linje afledt af en enkelt hybridomcelle, dvs. en hybridomcellelinje, opnås.De antistoffer, det producerer, er meget homogene antistoffer mod den samme antigene determinant, det vil sige monoklonale antistoffer.
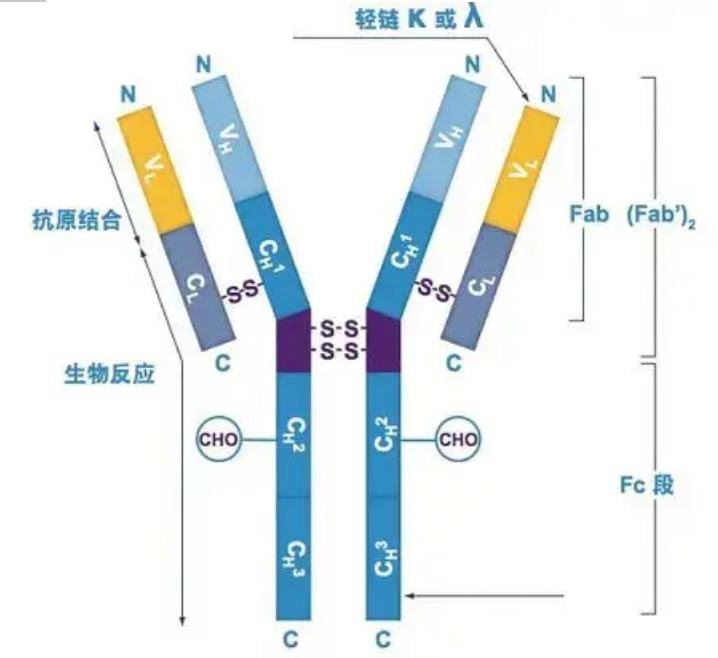
Antistoffer eksisterer som en eller flere Y-formede monomerer (dvs. monoklonale antistoffer eller polyklonale antistoffer).Hver Y-formet monomer er sammensat af 4 polypeptidkæder, herunder to identiske tunge kæder og to identiske lette kæder.Let kæde og tung kæde er navngivet efter deres molekylvægt.Toppen af den Y-formede struktur er den variable region, som er antigenbindingsstedet.(Uddrag fra Detai Bio-Monoclonal Antibody Concept)
Antistofstruktur
 Tung kæde
Tung kæde
Der er fem typer pattedyr Ig tunge kæder, navngivet med de græske bogstaver α, δ, ε, γ og μ.De tilsvarende antistoffer kaldes IgA, IgD, IgE, IgG og IgM.Forskellige tunge kæder er forskellige i størrelse og sammensætning.α og γ indeholder cirka 450 aminosyrer, mens μ og ε indeholder cirka 550 aminosyrer.
Hver tung kæde har to regioner: den konstante region og den variable region.Alle antistoffer af samme type har den samme konstante region, men der er forskel på antistoffer af forskellige typer.De konstante områder af de tunge kæder γ, α og δ er sammensat af tre Ig-domæner i tandem med en hængselregion for at øge dens fleksibilitet;de konstante områder af de tunge kæder μ og ε er sammensat af 4 Ig-domæner.Den variable region af den tunge kæde af antistoffet produceret af forskellige B-celler er forskellig, men den variable region af antistoffet produceret af den samme B-celle eller celleklon er den samme, og den variable region af hver tung kæde er omkring 110 aminosyrer lang., Og danner et enkelt Ig-domæne.
Let kæde
Der er kun to typer lette kæder hos pattedyr: lambda-type og kappa-type.Hver let kæde har to forbundne domæner: en konstant region og en variabel region.Længden af den lette kæde er omkring 211~217 aminosyrer.De to lette kæder indeholdt i hvert antistof er altid de samme.For pattedyr har den lette kæde i hvert antistof kun én type: kappa eller lambda.Hos nogle lavere hvirveldyr, såsom bruskfisk (bruskfisk) og benfisk, findes også andre typer lette kæder såsom iota (iota) typen.
Fab og Fc segmenter
Fc-segmentet kan kombineres direkte med enzymer eller fluorescerende farvestoffer for at mærke antistoffer.Det er den del, hvor antistoffet nitter på pladen under ELISA-processen, og det er også den del, hvor det andet antistof genkendes og bindes i immunpræcipitation, immunblotting og immunhistokemi.Antistoffer kan hydrolyseres til to F(ab)-segmenter og et Fc-segment af proteolytiske enzymer såsom papain, eller de kan brydes fra hængselregionen af pepsin og hydrolyseres til et F(ab)2-segment og et Fc-segment.IgG-antistoffragmenter er nogle gange meget nyttige.På grund af manglen på Fc-segmentet vil F(ab)-segmentet ikke præcipitere med antigenet, og det vil heller ikke blive fanget af immunceller i in vivo-undersøgelser.På grund af de små molekylære fragmenter og mangel på tværbindingsfunktion (på grund af manglen på Fc-segment) bruges Fab-segmentet sædvanligvis til radiomærkning i funktionelle undersøgelser, og Fc-segmentet bruges hovedsageligt som et blokeringsmiddel ved histokemisk farvning.
Variable og konstante regioner
Den variable region (V-region) er placeret ved 1/5 eller 1/4 (indeholdende ca. 118 aminosyrerester) af H-kæden nær N-terminalen og 1/2 (indeholder ca. 108-111 aminosyrerester) nær N-terminalen af L-kæden.Hver V-region har en peptidring dannet af intra-kæde disulfidbindinger, og hver peptidring indeholder ca. 67 til 75 aminosyrerester.Sammensætningen og arrangementet af aminosyrer i V-regionen bestemmer antistoffets antigenbindingsspecificitet.På grund af de stadigt skiftende typer og sekvens af aminosyrer i V-regionen kan der dannes mange slags antistoffer med forskellige bindingsantigenspecificiteter.V-regionerne i L-kæden og H-kæden kaldes henholdsvis VL og VH.I VL og VH har aminosyresammensætningen og sekvensen af nogle lokale regioner en højere grad af variation.Disse regioner kaldes hypervariable regioner (HVR).Aminosyresammensætningen og arrangementet af ikke-HVR-delene i V-regionen er relativt konservative, hvilket kaldes rammeregionen.Der er tre hypervariable regioner i VL, sædvanligvis placeret ved henholdsvis aminosyreresterne 24 til 34 og 89 til 97.De tre HVR'er af VL og VH kaldes henholdsvis HVR1, HVR2 og HVR3.Forskningen og analysen af røntgenkrystaldiffraktion viste, at den hypervariable region faktisk er stedet, hvor antistofantigenet binder, så det kaldes den komplementaritetsbestemmende region (CDR).HVR1, HVR2 og HVR3 af VL og VH kan kaldes henholdsvis CDR1, CDR2 og CDR3.Generelt har CDR3 en højere grad af hypervariabilitet.Den hypervariable region er også hovedstedet, hvor de idiotypiske determinanter af Ig-molekyler eksisterer.I de fleste tilfælde spiller H-kæden en vigtigere rolle ved binding til antigenet.
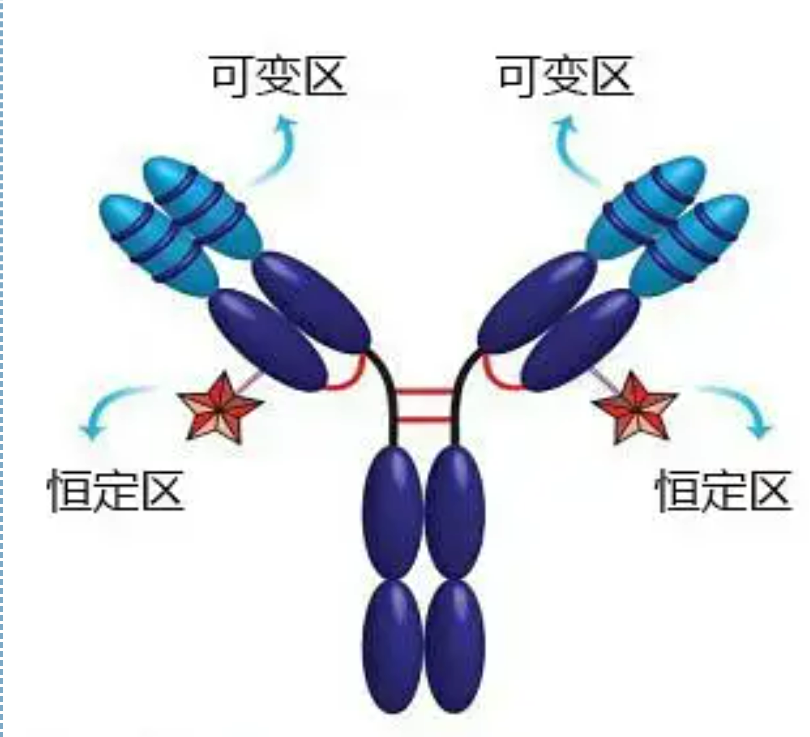 Den konstante region (C-region)er placeret ved 3/4 eller 4/5 (ca. fra aminosyre 119 til C-terminalen) af H-kæden nær C-terminalen og 1/2 (indeholder ca. 105 aminosyrerester) nær C-terminalen af L-kæden.Hver funktionel region af H-kæden indeholder omkring 110 aminosyrerester og indeholder en peptidring sammensat af 50-60 aminosyrerester forbundet med disulfidbindinger.Aminosyresammensætningen og arrangementet af denne region er relativt konstant i den samme dyre-Ig-isotype L-kæde og den samme type H-kæde.Det samme, det kan kun binde specifikt til det tilsvarende antigen, men strukturen af dets C-område er det samme, det vil sige, det har samme antigenicitet.Hestens anti-humane IgG sekundære antistof (eller anti-antistof) kan kombineres med de to. En kombination af antistoffer (IgG) mod forskellige exotoxiner forekommer.Dette er et vigtigt grundlag for fremstilling af sekundære antistoffer og påføring af fluorescein, isotoper, enzymer og andre mærkede antistoffer.
Den konstante region (C-region)er placeret ved 3/4 eller 4/5 (ca. fra aminosyre 119 til C-terminalen) af H-kæden nær C-terminalen og 1/2 (indeholder ca. 105 aminosyrerester) nær C-terminalen af L-kæden.Hver funktionel region af H-kæden indeholder omkring 110 aminosyrerester og indeholder en peptidring sammensat af 50-60 aminosyrerester forbundet med disulfidbindinger.Aminosyresammensætningen og arrangementet af denne region er relativt konstant i den samme dyre-Ig-isotype L-kæde og den samme type H-kæde.Det samme, det kan kun binde specifikt til det tilsvarende antigen, men strukturen af dets C-område er det samme, det vil sige, det har samme antigenicitet.Hestens anti-humane IgG sekundære antistof (eller anti-antistof) kan kombineres med de to. En kombination af antistoffer (IgG) mod forskellige exotoxiner forekommer.Dette er et vigtigt grundlag for fremstilling af sekundære antistoffer og påføring af fluorescein, isotoper, enzymer og andre mærkede antistoffer.
Relaterede produkter:
Cell Direct RT-qPCR kit
Indlægstid: 30. september 2021








