Ⅰ. Forøg reaktionssystemets følsomhed:
1. Adskil RNA af høj kvalitet:
Succesfuld cDNA-syntese kommer fra RNA af høj kvalitet.RNA af høj kvalitet bør sikre mindst en total længere og indeholder ikke inhibitorer, der ikke indeholder registreringsenzymer, såsom EDTA eller SDS.Kvaliteten af RNA bestemmer den maksimale værdi af den sekvensinformation, du kan transskribere til cDNA'et.Den generelle RNA-oprensningsmetode er en trinmetode til anvendelse af isoocyanat/acidophenol.For at forhindre forurening af RNase kræver RNA'et adskilt fra en prøve rig på RNase (såsom bugspytkirtlen) opbevaring af formaldehyd for at gemme RNA af høj kvalitet, hvilket er endnu mere til langtidsopbevaring.RNA'et ekstraheret fra rotteleveren blev som udgangspunkt nedbrudt efter en uges opbevaring i vand, mens RNA'et ekstraheret fra rottemilten forblev stabil efter tre års opbevaring i vand.Derudover er transkripter større end 4kb mere følsomme over for spor-RNase-nedbrydning end små transkripter.For at øge stabiliteten af lager-RNA-prøven kan RNA'et opløses i en methalmamin af ion og opbevares -70 °C.Thylid, der bruges til at redde RNA, må ikke indeholde en diverse genstand, der nedbryder RNA.RNA, som stammer fra bugspytkirtlen, kan gemmes i methalmamin i mindst et år.Når du er klar til at bruge RNA, kan du bruge følgende metoder til at udfælde RNA: tilsæt NaCl til 0,2 m og 4 gange volumen af ethanol, anbring stuetemperatur i 3-5 minutter og 10.000 × g centrifugal i 5 minutter.
2. Brug revers transkriptase uden RNaseH-aktivitet (RNaseH-):
RNase-hæmmere tilsættes ofte til reverse transkriptionsreaktioner for at øge længden og udbyttet af cDNA-syntese.RNase-inhibitor tilsættes i den første kædesyntesereaktion i nærvær af buffere og reduktionsmidler såsom DTT, fordi præ-cDNA-synteseprocessen denaturerer inhibitoren og derved frigiver bundne RNaser, der nedbryder RNA.Protein RNase-hæmmer forhindrer kun nedbrydning af RNA af RNase A, B, C og forhindrer ikke RNaser på huden, så man skal passe på ikke at indføre RNaser fra fingrene på trods af brugen af disse hæmmere.
Revers transkriptase katalyserer omdannelsen af RNA til cDNA.Både M-MLV og AMV har endogen RNaseH-aktivitet ud over deres egen polymeraseaktivitet.RNaseH-aktivitet konkurrerer med polymeraseaktivitet for heterozygote strenge dannet mellem RNA-templates og DNA-primere eller cDNA-forlængelsestrenge og nedbryder RNA: RNA-strenge i DNA-komplekser.RNA-skabeloner nedbrudt af RNaseH-aktivitet kan ikke længere bruges som effektive substrater til cDNA-syntese, hvilket reducerer udbyttet og længden af cDNA-syntese.Eliminering eller kraftig reduktion af RNaseH-aktivitet af revers transkriptase ville således være til stor fordel.
SuperScriptⅡ revers transkriptase, MMLV revers transkriptase af RNaseH- og thermoScript revers transcriptase, AMV af RNaseH- gav mere fuldlængde cDNA end MMLV og AMV.RT-PCR-følsomhed påvirkes af mængden af syntetiseret cDNA.ThermoScript er meget mere følsomt end AMV.Størrelsen af RT-PCR-produkter er begrænset af revers transkriptases evne til at syntetisere cDNA, især ved kloning af større Cdna'er.Sammenlignet med MMLV øgede SuperScripⅡ signifikant udbyttet af lange RT-PCR-produkter.RNaseH-s omvendte transkriptase øger også den termiske stabilitet, så reaktionen kan udføres ved temperaturer højere end normalt på 37-42 ℃.Under de foreslåede syntesebetingelser blev oligo(dT)-primere og 10μCi [alpha-p]dCTP anvendt.Den samlede produktion af den første kæde blev beregnet ved hjælp af TCA-fældningsmetoden.Fuldlængde cDNA blev analyseret under anvendelse af størrelsessorteret strimmelfjernelse og optælling i en alkalisk agarosegel.
3. Forøg varmekonserveringstemperaturen for omvendt transskription:
Højere holdetemperatur hjælper med at åbne den sekundære struktur af RNA og øge udbyttet af reaktionen.For de fleste RNA-skabeloner elimineres de fleste sekundære strukturer ved at holde RNA'et og primeren ved 65°C uden buffer eller salt og derefter afkøle dem hurtigt på is og tillader primerne at binde.Nogle skabeloner har dog stadig sekundær struktur, selv efter termisk denaturering.Amplifikation af disse vanskelige skabeloner kan udføres ved hjælp af ThermoScript revers transkriptase og ved at placere revers transkriptasereaktionen ved højere temperaturer for at forbedre amplifikationen.Højere holdetemperaturer kan også øge specificiteten, især når cDNA-syntese udføres ved hjælp af genspecifikke primere (GSPS) (se kapitel 3).Hvis du bruger GSP, skal du sørge for, at Tm-værdien af primeren er den samme som den forventede holdetemperatur.Brug ikke oligo(dT) og tilfældige primere over 60 ℃.Tilfældige primere skal holdes ved 25 ℃ i 10 minutter, før de øges til 60 ℃.Ud over at bruge højere revers transkriptionstemperaturer kan specificiteten forbedres ved direkte at overføre RNA/primer-blandingen fra 65℃ denatureringstemperaturen til revers transkriptionsholdetemperaturen og tilføje en forvarmet 2× reaktionsblanding (cDNA termisk initieringssyntese).Denne tilgang hjælper med at forhindre den intermolekylære baseparring, der opstår ved lavere temperaturer.Brug af et PCR-instrument forenkler de mange temperaturkontakter, der kræves til RT-PCR.
Den varmestabiliserede polymerase virker som DNA-polymerase i nærvær af Mg2+ og RNA-polymerase i nærvær af Mn2+.Den kan holde varme ved op til 65 ℃.Tilstedeværelsen af Mn2+ under PCR reducerer imidlertid pålideligheden, hvilket gør Tth-polymerase mindre egnet til højpræcisionsforstærkning, såsom cDNA-kloning.Derudover er Tth mindre effektiv til revers transkription, hvilket reducerer følsomheden, og da et enkelt enzym kan udføre revers transkription og PCR, kan kontrolreaktioner uden revers transkription ikke bruges til at skelne amplificerede cDNA-produkter fra kontamineret genomisk DNA.
4. Additiv, der fremmer omvendt transkription:
Tilføjelsen af additiver, herunder glycerin og DMSO, til den første kædesyntesereaktion kan reducere stabiliteten af nukleinsyre-dobbeltstrengen og afvikle den sekundære RNA-struktur.Op til 20 % glycerin eller 10 % DMSO kan tilsættes uden at påvirke aktiviteten af SuperScriptⅡ eller MMLV.AMV kan også tåle op til 20% glycerol uden at reducere aktiviteten.For at maksimere følsomheden af RT-PCR i SuperScriptⅡ revers transkriptionsreaktion kan 10% glycerol tilsættes og isoleres ved 45℃.Hvis 1/10 af retrotranskriptions-reaktionsproduktet tilsættes til PCR, er koncentrationen af glycerol i amplifikationsreaktionen 0,4 %, hvilket ikke er nok til at hæmme PCR.
5. RNaseH-behandling:
Følsomhed kan forbedres ved at behandle cDNA-syntesereaktioner med RNaseH før PCR.For nogle skabeloner menes det, at RNA'et i cDNA-syntesereaktionen forhindrer bindingen af amplificerede produkter, i hvilket tilfælde RNaseH-behandlingen kan øge følsomheden.Generelt er RNaseH-behandling påkrævet til amplifikation af en relativt lang cDNA-målskabelon i fuld længde, såsom tuberøs scherosisⅡ med lav kopi.For denne vanskelige skabelon forbedrede RNaseH signalet genereret af cDNA'et syntetiseret af SuperScriptⅡ eller AMV.For de fleste RT-PCR-reaktioner er RNaseH-behandlingen valgfri, fordi det 95℃-isolerede PCR-denatureringstrin typisk hydrolyserer RNA'et fra RNA:DNA-komplekset.
6. Forbedrede metoder til påvisning af små mængder RNA:
RT-PCR er særligt udfordrende, når kun små mængder RNA er tilgængelige.Tilsætning af glykogen som bærer under RNA-separation hjælper med at øge udbyttet af små prøver.Et RNase-frit glykogen kan tilsættes samtidig med Trizol.Glykogen er vandopløseligt og kan forblive i vandfasen med RNA for at hjælpe med efterfølgende udfældning.Den anbefalede koncentration af RNase-frit glykogen er 250 μg/ml for prøver på mindre end 50 mg væv eller 106 dyrkede celler.
Tilsætning af acetyleret BSA til reverse transkriptionsreaktioner ved hjælp af SuperScriptⅡ kan øge følsomheden, og for små mængder RNA kan reduktion af mængden af SuperScriptⅡ og tilføjelse af 40 enheder RNaseOut nukleasehæmmer forbedre detektionsniveauet.Hvis glykogen anvendes til RNA-separation, anbefales det stadig at tilføje BSA- eller RNase-hæmmere for at vende transkriptionsreaktioner ved hjælp af SuperScriptⅡ.
Ⅱ. Forøg specificiteten af RT-PCR
1. cNDA syntese:
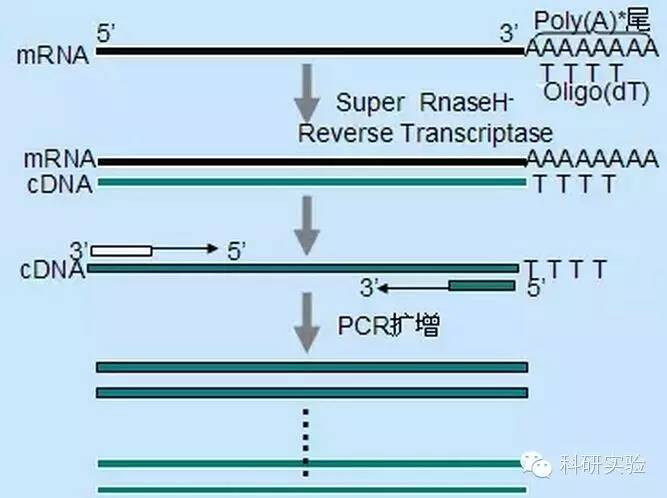
Tre forskellige metoder kan anvendes til at initiere første streng cDNA syntese, og den relative specificitet af hver metode påvirker mængden og typen af syntetiseret cDNA.
Tilfældig primermetode er den mindst specifikke af de tre metoder.Primere anneales på flere steder i hele transkriptet for at producere kort, delvis længde cDNA.Denne metode bruges ofte til at opnå 5'-terminale sekvenser og cDNA fra RNA-skabeloner med sekundære strukturelle regioner eller med terminerende steder, som revers transkriptase ikke kan replikere.For at opnå det længste cDNA skal forholdet mellem primere og RNA i hver RNA-prøve bestemmes empirisk.Den indledende koncentration af tilfældige primere varierer fra 50 til 250 ng pr. 20 μl reaktionssystem.Fordi cDNA'et syntetiseret fra totalt RNA ved anvendelse af tilfældige primere hovedsageligt er ribosomalt RNA, vælges poly(A)+RNA generelt som skabelonen.
Oligo(dT)-initiering er mere specifik end tilfældige primere.Det hybridiserer med poly(A)-halen, der findes i 3'-enden af mRNA i de fleste eukaryote celler.Fordi poly(A)+RNA er omkring 1 % til 2 % af total RNA, er mængden og kompleksiteten af cDNA meget mindre, end hvis tilfældige primere blev brugt.På grund af dets høje specificitet kræver oligo(dT) generelt ikke optimering for RNA til primer-forhold og poly(A)+-selektion.Det anbefales at bruge 0,5 μg oligo(dT) pr. 20 μl reaktionssystem.oligo(dT)12-18 er velegnet til de fleste RT-PCR.ThermoScript RT-PCR System giver oligo(dT)20 på grund af dets gode termiske stabilitet og er velegnet til højere holdetemperaturer.
Genspecifikke primere (GSP) er de bedste specifikke primere til det omvendte transkriptionstrin.GSP er et antisense-oligonukleosid, der specifikt kan hybridisere med RNA-destinationssekvenser i stedet for at anneale alle RNA'er som tilfældige primere eller oligo(dT).Reglerne, der bruges til at designe PCR-primere, gælder også for design af revers transkriptionsreaktion GSP.GSP kan være den samme sekvens som amplifikationsprimeren annealet i enden af mRNA3', eller GSP kan designes til at blive annealet nedstrøms med den omvendte amplifikationsprimer.For nogle amplificerede objekter er det nødvendigt at designe mere end én antisense-primer til vellykket RT-PCR, fordi den sekundære struktur af mål-RNA'et kan forhindre primeren i at binde.Det foreslås at bruge 1pmol antisense GSP i det første kædesyntesereaktionssystem på 20μl.
2. Øg varmekonserveringstemperaturen for omvendt transskription:
For at drage fuld fordel af GSP-specificitet bør revers transkriptase med høj termisk stabilitet anvendes.Varmestabil revers transkriptase kan isoleres ved højere temperaturer for at øge reaktionsstrengheden.For eksempel, hvis en GSP anneales ved 55°C, så udnyttes specificiteten af GSP ikke fuldt ud, hvis revers transkription udføres ved 37°C med lav rigor under anvendelse af AMV eller M-MLV.SuperScripⅡ og ThermoScript kan dog reagere ved 50℃ eller højere, hvilket eliminerer uspecifikke produkter produceret ved lavere temperaturer.For maksimal specificitet kan RNA/primer-blandingen overføres direkte fra 65℃ denatureringstemperaturen til revers transkriptionsholdetemperaturen med tilsætning af en forvarmet 2 x reaktionsblanding (termisk initiering af cDNA-syntese).Dette hjælper med at forhindre baseparring mellem molekyler ved lave temperaturer.Brug af et PCR-instrument forenkler de mange temperaturovergange, der kræves til RT-PCR.
3. Reducer genomisk DNA-kontamination:
En potentiel vanskelighed med RT-PCR er, at RNA forurener genomisk DNA.Brugen af bedre RNA-separationsmetoder, såsom Trizol Reagent, reducerer genomisk DNA-kontamination i RNA-præparater.For at undgå produkter produceret fra genomisk DNA kan RNA'et behandles med amplifikationsgrad DnasⅠ for at fjerne kontamineret DNA før omvendt transkription.Prøverne blev holdt ved 65 ℃ i 2,0 mM EDTA i 10 minutter for at afslutte DNaseⅠ-fordøjelsen.EDTA chelaterer magnesiumioner for at forhindre den magnesiumionafhængige RNA-hydrolyse, der forekommer ved høje temperaturer.
For at adskille amplificeret cDNA fra genom-DNA-amplifikationsproduktet kan primere, der annealer separat med det adskilte exon, designes.PCR-produkter afledt af cDNA vil være kortere end dem, der er afledt af kontamineret genomisk DNA.Et kontrolleret eksperiment uden omvendt transkription udføres også på hver RNA-skabelon for at bestemme, om et givet fragment er fra genomisk DNA eller cDNA.PCR-produkter opnået i fravær af revers transkription er afledt fra genomet.
Relateret produkt
-Et-trins kittet gør det muligt at udføre revers transkription og PCR i samme rør.Det behøver kun at tilføje skabelon-RNA, specifikke PCR-primere og RNase-fri ddH2O.
-Kvantitativ realtidsanalyse af RNA kan udføres hurtigt og præcist.
-Sættet bruger et unikt Foregene revers transkriptionsreagens og Foregene HotStar Taq DNA Polymerase kombineret med et unikt reaktionssystem for effektivt at forbedre amplifikationseffektiviteten og specificiteten af reaktionen.
-Det optimerede reaktionssystem gør, at reaktionen har højere detektionsfølsomhed, stærkere termisk stabilitet og bedre tolerance.
RT Easy II(Med GDNase) Master Premix til første-strengs CDNA-syntese til realtids-PCR med GDNase
-Effektiv evne til at fjerne gDNA, som kan fjerne gDNA i skabelonen inden for 2 minutter.
-Effektivt omvendt transkriptionssystem, det tager kun 15 minutter at fuldføre syntesen af det første streng cDNA.
-Komplekse skabeloner: skabeloner med højt GC-indhold og kompleks sekundær struktur kan også vendes med høj effektivitet.
-Højfølsomt revers transkriptionssystem, pg-niveau skabeloner kan også få cDNA af høj kvalitet.
- Det omvendte transkriptionssystem har høj termisk stabilitet, den optimale reaktionstemperatur er 42 ℃, og det har stadig en god revers transkriptionsydelse ved 50 ℃.
Posttid: Mar-07-2023