Oversigt
Hurtig identifikation af transgene planter
Tekst/Tong Yucheng
Eksperimentel drift/Han Ying
Redaktør/Wen Youjun
Ord/1600+
Foreslået læsetid/8-10 minutter
Hurtig identifikation af transgene planter
Som ny i laboratoriet er det ikke et godt stykke arbejde at frasortere positive planter fra en flok planter med lav omdannelsesrate.For det første skal DNA ekstraheres fra et stort antal prøver én efter én, og derefter vil de fremmede gener blive påvist ved PCR.Resultaterne er dog ofte blanks og bånd med nogle få elementer af og til, men det er umuligt at afgøre, om der er manglende eller falske registreringer..Er det meget hjælpeløst at stå over for sådanne eksperimentelle processer og resultater?Bare rolig, bror lærer dig, hvordan du nemt og præcist kan frasortere transgene positive planter.
Trin 1: Designdetektionsprimere
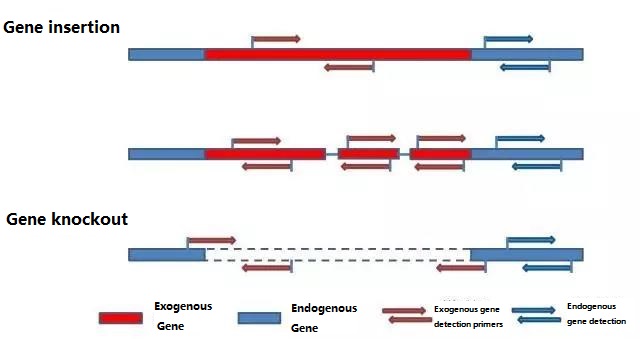
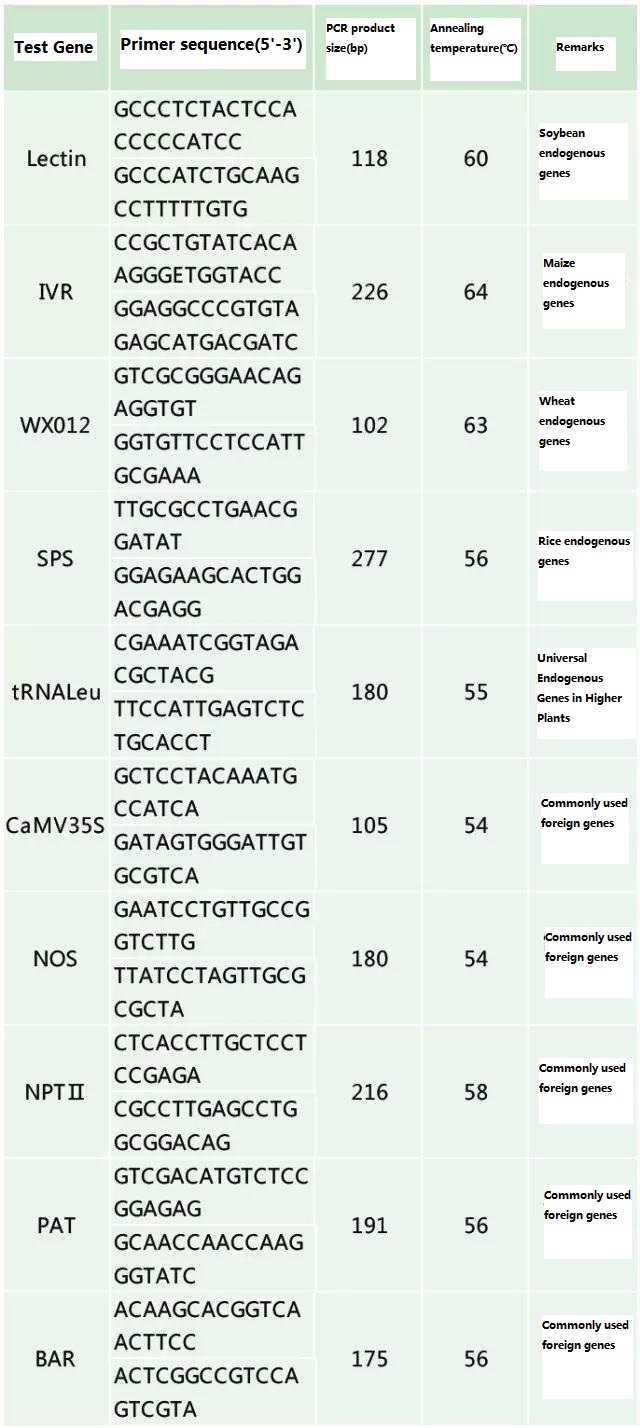
Bestem det endogene gen og det eksogene gen, der skal påvises i henhold til prøven, der skal testes, og vælg en repræsentativ 100-500 bp sekvens i genet til primerdesign.Gode primere kan sikre nøjagtigheden af detektionsresultaterne og forkorte detektionstiden (se appendiks for almindeligt anvendte detektionsprimere).
Bemærk:
De nydesignede primere skal optimere reaktionsbetingelserne og verificere nøjagtigheden, præcisionen og detektionsgrænsen for detektionen, før de udfører detektion i stor skala.
Trin 2:Udvikle eksperimentel protokol

Positiv kontrol: Brug det oprensede DNA, der indeholder målfragmentet, som skabelon til at bestemme, om PCR-reaktionssystemet og -betingelserne er normale.
Negativ/blank kontrol: Brug en DNA-skabelon eller ddH2O, der ikke indeholder målfragmentet som skabelon til at detektere, om der er en kilde til kontaminering i PCR-systemet.
Intern referencekontrol: Brug primer/probe-kombinationen af det endogene gen i prøven, der skal testes, til at evaluere, om skabelonen kan påvises ved PCR.
Bemærk:
Positive, negative/blanke kontroller og interne kontrolkontroller bør indstilles for hver test for at evaluere validiteten af de eksperimentelle resultater.
Trin 3: Eksperimentforberedelse

Før brug skal du observere, om opløsningen er jævnt blandet.Hvis der konstateres nedbør, skal det opløses og blandes i henhold til instruktionerne før brug.2×PCR-blanding skal pipetteres og blandes gentagne gange med en mikropipette før brug for at undgå ujævn ionfordeling.
Bemærk:
Tag instruktionerne ud og læs dem omhyggeligt, og gør forberedelser inden eksperimentet i nøje overensstemmelse med instruktionerne.
Trin 4: Forbered PCR-reaktionssystem
I henhold til den eksperimentelle protokol blandes primerne, H2O, 2×PCR-blanding, centrifuger og fordel dem til hvert reaktionsrør.
Bemærk:
Til storskala eller langtidstestning anbefales det at bruge et PCR-reaktionssystem indeholdende UNG-enzym, som effektivt kan undgå aerosolkontamination forårsaget af PCR-produkter.
Trin 5: Tilføj reaktionsskabelon

Ved at bruge Direct PCR-teknologi er der ikke behov for en kedelig nukleinsyreoprensningsproces.Prøveskabelonen kan fremstilles inden for 10 minutter og tilføjes til det tilsvarende PCR-reaktionssystem.
Bemærk:
Lysis-metoden har bedre detektionseffekt, og det opnåede produkt kan bruges til flere detektionsreaktioner.
5.1: Direkte PCR af blade
I henhold til størrelsen på billedet i manualen skæres bladvævet med en diameter på 2-3 mm og placeres i PCR-reaktionssystemet.
Bemærk: Sørg for, at bladfragmenterne er helt nedsænket i PCR-reaktionsopløsningen, og tilsæt ikke for meget bladvæv.
5.2: Bladlysemetode
Skær bladvævet med en diameter på 5-7 mm og læg det i et centrifugerør.Hvis du vælger modne blade, skal du undgå at bruge vævene i bladets hovedåre.Pipetter 50 ul Buffer P1-lysat i et centrifugerør for at sikre, at lysatet helt kan nedsænke bladvævet, anbring det i en termisk cyklus eller et metalbad, og lysér ved 95°C i 5-10 minutter.


Tilsæt 50 ul buffer P2 neutraliseringsopløsning og bland godt.Det resulterende lysat kan anvendes som skabelon og tilsættes PCR-reaktionssystemet.
Bemærk: Mængden af skabelon skal være mellem 5-10 % af PCR-systemet og bør ikke overstige 20 % (i et 20 μl PCR-system tilsættes f.eks. 1-2 μl lyseringsbuffer, ikke mere end 4 μl).
Trin 6: PCR-reaktion

Efter centrifugering af PCR-reaktionsrøret placeres dem i et PCR-instrument til amplifikation.
Bemærk:
Reaktionen anvender ikke-oprenset template til amplifikation, så antallet af amplifikationscyklusser er 5-10 flere cyklusser end ved brug af oprenset DNA-skabelon.
Trin 7: Elektroforesedetektion og resultatanalyse

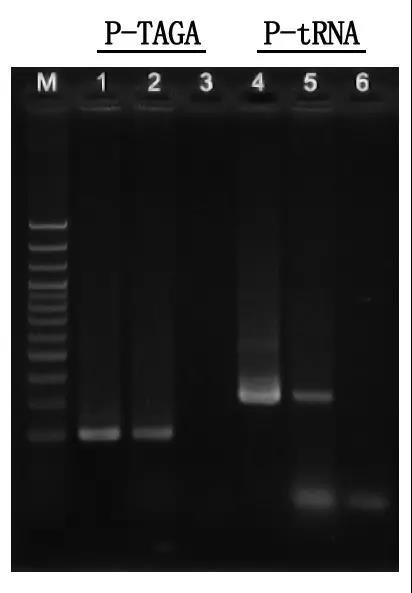
M:100bp DNA-stige
1\4: Oprenset DNA-metode
2\5: Direkte PCR-metode
3\6: Tom kontrol
Kvalitetskontrol:
Testresultaterne for de forskellige kontroller, der er sat i eksperimentet, skal opfylde følgende betingelser.Ellers bør årsagen til problemet analyseres, og testen skal udføres igen, efter at problemet er elimineret.
Tabel 1. Normale testresultater for forskellige kontrolgrupper

*Når plasmidet bruges som en positiv kontrol, kan resultatet af endogene gentest være negativt
Resultat bedømmelse:
A. Testresultatet af det endogene gen i prøven er negativt, hvilket indikerer, at DNA'et, der er egnet til almindelig PCR-detektion, ikke kan ekstraheres fra prøven, eller det ekstraherede DNA indeholder PCR-reaktionshæmmere, og DNA'et skal ekstraheres igen.
B. Testresultatet af det endogene gen i prøven er positivt, og testresultatet af det eksogene gen er negativt, hvilket indikerer, at det DNA, der er egnet til almindelig PCR-detektion, er ekstraheret fra prøven, og det kan vurderes, at XXX-genet ikke er påvist i prøven.
C. Testresultatet af det endogene gen i prøven er positivt, og testresultatet af det eksogene gen er positivt, hvilket indikerer, at det DNA, der er egnet til almindelig PCR-detektion, er blevet ekstraheret fra prøven, og prøve-DNA'et indeholder XXX-genet.Konfirmationsforsøg kan udføres yderligere.
Trin 8: Design detektionsprimere

Efter eksperimentet skal du bruge 2% natriumhypochloritopløsning og 70% ethanolopløsning til at tørre forsøgsområdet for at forhindre miljøforurening.
bilag
Tabel 2. Almindeligt anvendte primere til generel PCR-detektion af genetisk modificerede planter
Referencedokument:
SN/T 1202-2010, Kvalitativ PCR-detektionsmetode for genetisk modificerede planteingredienser i fødevarer.
Landbrugsministeriets meddelelse 1485-5-2010, Test af ingredienserne i genetisk modificerede planter og deres produkter - ris M12 og dets derivater.
Indlægstid: 09-06-2021








