PCR, mange PCR, In situ PCR, Omvendt PCR, RT-PCR, qPCR(1)–PCR
Vi vil sortere koncepterne, trinene og detaljerne i forskellige PCR
Ⅰ. PCR
Polymerase Chain Reaction, omtalt som PCR, er en molekylærbiologisk teknologi, der bruges til at forstørre specifikke DNA-fragmenter.Det kan betragtes som en speciel DNA-replikation in vitro.DNA-polymerase (DNA Polymerase I) blev opdaget så tidligt som i 1955, og Klenow Fragment of E. Coli, som har eksperimentel værdi og praktisk, blev opdaget af Dr. H. Klenow i begyndelsen af 1970'erne, men fordi dette enzym ikke tåler temperatur, kan høj temperatur degenerere det, så det møder ikke polymerase-degenerationskædereaktionen ved høj temperatur.De enzymer, der er i brug i dag (kaldet Taq polymerase), blev isoleret fra Thermus aquaticus, en varmekildebakterie i 1976. Dens egenskab er, at den kan modstå høje temperaturer og er et ideelt enzym, men det er meget brugt efter 1980'erne.Det oprindelige koncept for den oprindelige primitive prototype af PCR ligner genreparation og -kopiering, som blev foreslået af Dr. KJell Kleppe i 1971. Han udgav den første simple og kortsigtede genkopi (svarende til de to første cyklusreaktioner af PCR).Den PCR, der er udviklet i dag, blev udviklet af Dr. Kary B. Mullis i 1983. Dr. Mullis tjente PE-virksomheder det år, så PE har en særlig status i PCR-industrien.Dr. Mullis offentliggjorde officielt det første relaterede papir med Saiki og andre i 1985. Siden da er brugen af PCR tusindvis af miles om dagen, og kvaliteten af relaterede artikler kan siges at gøre mange andre forskningsmetoder usmagelige.Efterfølgende er PCR-teknologi meget udbredt i biologisk videnskabelig forskning og kliniske anvendelser, og bliver den vigtigste teknologi inden for molekylærbiologisk forskning.Mullis vandt også 1993 Nobelprisen i kemi.
PCRPrincip
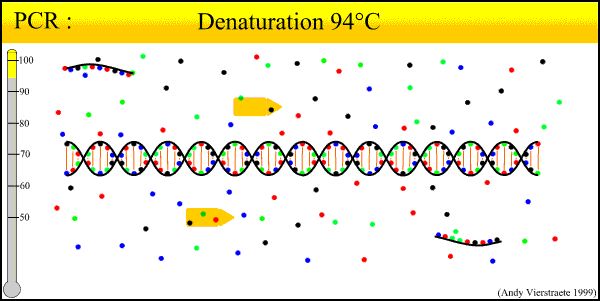
Det grundlæggende princip for PCR-teknologi ligner den naturlige replikationsproces af DNA, og dens specificitet afhænger af oligonukleotidprimeren, der er komplementær til begge ender af målsekvensen.PCR er sammensat af degeneration-annealing-forlængende tre grundlæggende reaktionstrin: ①Degeneration af template-DNA: Efter at template-DNA'et er opvarmet til ca. 93°C i et vist tidsrum, gør den dobbelte DNA-opløsning for det dobbeltkædede DNA dannet ved PCR-amplifikationen af template-DNA'et, der forlader, det til en enkelt kæde med den næste primer-reaktion, så den kan kombineres til den næste primer-reaktion.②Anneleringen (forbindelsen) af template-DNA'et og primeren: Efter at template-DNA'et er opvarmet og degenereret til en enkelt kæde, falder temperaturen til ca. 55°C.Den komplementære sekvens af primeren og template-DNA enkeltkædet.③Forlængelsen af primeren: DNA-skabelon - primerbindingen er baseret på virkningen af TaqDNA-polymerase, med dNTP som reaktionsråmaterialet.Hold replikationsprincippet, syntetiser en ny semi-reserveret kopikæde, der komplementerer skabelon-DNA-kæden, og gentag cyklus degeneration-annealing-forlængelse tre processer kan få mere "semi-reserveret kopi kæde", og denne nye kæde er tilgængelig igen Bliv skabelon for den næste cyklus.Det tager 2-4 minutter at fuldføre løkken, målgenet kan amplificeres flere millioner gange på 2-3 timer.
StandardPCRReaktionssystem
| Taq DNA polymerase | 2,5 μl |
| Mg2+ | 1,5 mmol/L |
| 10× amplifikationsbuffer | 10 μl |
| 4 dNTP blandinger | 200 μl |
| Skabelon DNA | 0,1~2μg |
| Primer | 10~100μl |
| Tilsæt dobbelt eller tredobbelt dampende vand | 100 μl |
Fem elementer af PCR-reaktion
Der er hovedsageligt fem slags stoffer involveret i PCR-reaktionen, nemlig primer, enzym, dNTP, template og buffer (Mg2+ er påkrævet).[PCR-procedure]
Standard PCR-processen er opdelt i tre trin
1. DNA-degenerering (90°C-96°C): Dobbeltkædede DNA-skabeloner under termisk virkning, hydrogenbindinger brydes og danner et enkeltkædet DNA.
2. Udglødning (25℃ -65℃): Systemtemperaturen reduceres, primeren kombineres med DNA-skabelonen for at danne en lokal dobbeltkæde.
3. Forlængelse (70℃ -75℃): Under påvirkning af Taq-enzymet (ca. 72°C, den bedste aktivitet), bruges dNTP som råmateriale, strækker sig fra 5′-enden af primeren → 3′-enden, syntese og template komplementerer hinandens DNA-kæde.
Hver cyklus denatureres, anneales og forlænges, hvilket fordobler DNA-indholdet.På nuværende tidspunkt, på grund af det korte amplifikationsområde, kan noget PCR replikeres på meget kort tid, selvom Taq enzymaktiviteten ikke er optimal, så den kan ændres til to trin, det vil sige, at annealingen og forlængelsen kan udføres ved 60°C-65°C på samme tid.For at reducere processen med at løfte og afkøle og forbedre responshastigheden.
PCR-reaktionsfunktioner
● Høj specificitet
De specifikke afgørende faktorer for PCR-responset er: ①Den specifikke kombination af primeren og template-DNA'et.② Princippet om baseparring.③Loyaliteten ved TaqDNA-polymerasesyntesereaktionen.④Målgenets specificitet og konservativitet.
Den korrekte kombination af primere og skabeloner er nøglen.Bindingen af primeren og skabelonen og forlængelsen af primerkæden er baseret på princippet om alkalisk basetilpasning.Loyaliteten af polymerasesyntesereaktioner og den høje temperaturresistens af Taq DNA-polymerasen til at skabe bindingen (forbindelsen) af templaten og primeren i reaktionen kan udføres ved en højere temperatur.Kombinationens specificitet er stærkt forøget.Klippet kan opretholde en høj grad af korrekthed.Ved at vælge en genetisk målregion med høj konservativitet og høj konservativitet er dens specificitet højere.
● Høj følsomhed
Produktionsvolumen af PCR-produkter øges med indeks, hvilket kan udvide startskabelonen for Picker (PG=10-12) for at øge niveauet af mikrocontroller til niveauet af mikrogram (μg= -6).En målcelle kan påvises fra 1 million celler;ved påvisning af vira kan følsomheden af PCR nå 3 RFU'er (tomme pletter dannede enheder);den mindste detektionsrate i bakteriel videnskab er 3 bakterier.
● Enkel og hurtig
PCR-reflektionen bruger en højtemperatur Taq DNA-polymerase, som tilføjer reaktionsopløsningen på én gang, det vil sige en degeneration-anneal-forlængelse-reaktion på DNA-amplifikationsopløsningen og vandbadekar.Generelt er amplifikationsreaktionen afsluttet på 2 til 4 timer.Forstærkede produkter analyseres generelt med elektriske sværd og behøver ikke at bruge isotoper, ingen radioaktiv forurening og nem reklame.
● Prøvens renhed er lav
Der er ingen grund til at adskille vira eller bakterier og dyrkningsceller.DNA-råprodukter og RNA kan bruges som forstærkere.DNA-amplifikationsdetektion kan bruges direkte ved hjælp af kliniske prøver såsom blod, kropsvæske, hostevæske, hår, celler og levende væv.
PCRalmindelige problemer
● Falsk negativ, ingen forstærkede bånd
De vigtigste stadier af PCR-reaktionen omfatter: ① fremstilling af template-nukleinsyrer, ② kvalitet og specificitet af primere, ③ kvaliteten af enzymer ④ PCR-cyklusbetingelser.At finde årsagen bør også analyseres og studeres for ovenstående links.
Skabeloner: ① Skabelonen indeholder diverse proteiner, ② Skabelonen indeholder en Taq-enzymhæmmer, ③ Proteinet i skabelonen er ikke elimineret, især gruppeproteinet i kromosomet.⑤ Deminer-nukleinsyredegenerering er ikke grundig.Når kvaliteten af enzymer og primere er god, er der ikke noget amplifikationsbånd, hvilket højst sandsynligt er fordøjelsesbehandlingen af prøver.Der er noget galt med skabelonnukleinsyreekstraktionsprocessen, så for at forberede en effektiv og stabil fordøjelsesopløsning, bør dens procedure være fast og ikke ændres vilkårligt.
Enzyminaktivering: et nyt enzym eller både gamle og nye enzymer bør bruges sammen til at analysere, om enzymaktiviteten er tabt eller utilstrækkelig, hvilket fører til falske negativer.Det skal bemærkes, at Taq-enzym eller ethidiumbromid nogle gange glemmes.
Primer: kvaliteten af primeren, koncentrationen af primeren, og om koncentrationen af de to primere er symmetrisk.Det er en almindelig årsag til PCR-fejlen, eller det stigende bånd er ikke ideelt og tilbøjeligt til at diffundere.Der er problemer med kvaliteten af primerne for nogle batchnumre.De to primere har en høj koncentration og en lav koncentration, hvilket forårsager laveffektiv asymmetrisk amplifikation.Modforanstaltningerne er: ① Vælg en god primer til at syntetisere enheder.② Koncentrationen af primeren afhænger ikke kun af OD-værdien, men er også opmærksom på primerens originale væske for at lave agar-sukkergelelektroforese.Der skal være en primerstrimmelzone, og lysstyrken af de to primere skal generelt være konsistent.Bælte, PCR kan mislykkes på dette tidspunkt, og det bør løses med primersynteseenheden.Hvis en primer er høj, er lysstyrken lav, og dens koncentration skal afbalanceres, når den fortyndes.③ Primeren skal betales og opbevares i en høj koncentration for at forhindre flere frysninger eller langvarige køledele af køleskabet, hvilket vil få primeren til at forringes og nedbrydes.④ Designet af primeren er urimeligt, såsom længden af primeren er utilstrækkelig, og diclusteren dannes mellem primerne.
Mg2+koncentration: Mg2+ionkoncentration har stor indflydelse på PCR-amplifikationseffektiviteten.For høj koncentration kan reducere det modsatte køn af PCR-amplifikation.Hvis koncentrationen er for lav, vil PCR-amplifikationsoutputtet endda bevirke, at PCR-amplifikationen fejler uden ekspansionsbåndet.
Ændring af reaktionsvolumen: Volumenet anvendt til PCR-amplifikation er 20 ul, 30 ul og 50 ul eller 100 ul, det store volumen af ansøgningen om PCR-amplifikation er indstillet i overensstemmelse med forskellige formål med videnskabelig forskning og klinisk testning.Efter at have lavet små mængder såsom 20ul, er det nødvendigt at lave en ledningstilstand, når du laver størrelsen, ellers vil den mislykkes.
Fysiske årsager: Transformation er meget vigtig for PCR-amplifikation.Hvis degenerationstemperaturen er lav, er degenerationstiden kort, det vil sandsynligvis forekomme i falske negativer;for lav annealingstemperatur kan forårsage uspecifik amplifikation og reducere specifik amplifikationseffektivitet.Påvirker i høj grad kombinationen af primere og skabeloner for at reducere PCR-amplifikationseffektiviteten.Nogle gange er det nødvendigt at bruge standardtermometre til at detektere variabiliteten, udglødningen og den forlængede temperatur i forlængelses- eller vandopløselige komfur, hvilket er en af årsagerne til fejlen i PCR.
Målsekvensvarianter: Hvis målsekvensen forekommer, en mutation eller deletion, kombineres kombinationen af prototypen og skabelonen, eller på grund af manglen på en målsekvens vil primeren og skabelonen miste den komplementære sekvens, og dens PCR-amplifikation vil ikke være vellykket.
● Falsk positiv
PCR-amplifikationsbåndet ser ud til at være i overensstemmelse med målsekvensbåndet, og nogle gange er dets bånd mere pænt og højere.
Primerdesign er ikke passende: den valgte amplifikationssekvens og non-purpose amplifikationssekvens er homolog, så når PCR-amplifikation er de amplificerede PCR-produkter ikke-formålsfulde sekvenser.Målsekvensen er for kort, eller primeren er for kort, og den er tilbøjelig til at være falsk positiv.Skal omdesignes.
Krydsforurening af målsekvens eller amplifikationsprodukter: Der er to årsager til denne forurening: For det første krydsforurening af hele genomet eller store segmenter, hvilket fører til falske positiver.Denne form for falsk positiv kan løses ved hjælp af følgende metoder: Vær forsigtig og skånsom under driften for at forhindre, at målsekvensen inhaleres ind i prøvepistolen eller sprøjter ud af centrifugalrøret.Bortset fra enzymer og stoffer, der ikke kan modstå høje temperaturer, bør alle reagenser eller udstyr desinficeres med højt tryk.Centrifugalrørene og prøverne skal bruges på én gang.Når det er nødvendigt, før tilsætning af prøver, udsættes reaktionsrøret og reagenset for ultraviolette stråler for at ødelægge den eksisterende nukleinsyre.For det andet små fragmenter i luftforureningen.Disse små fragmenter er kortere end målsekvensen, men de har en vis homologi.Det kan splejses med hinanden.Efter komplementering af primerne kan PCR-produktet udvides, hvilket vil forårsage falsk positiv produktion.Den kan bruges til at reducere eller eliminere nest PCR-metoden.
● Vises uspecifikt forstærkningsbånd
De bånd, der dukkede op efter PCR-amplifikation, er inkonsistente med den forventede størrelse, eller store eller små, eller på samme tid eller på samme tid, specifikke amplifikationsbånd og ikke-specifikke amplifikationsbånd.Fremkomsten af ikke-specifikke bånd er: For det første er primerne ufuldstændige komplementære til målsekvensen, eller polymerisationen af primeren til dannelse af en dicluster.Den anden er, at koncentrationen af MG2+ioner er for høj, annealingstemperaturen er for lav, og antallet af PCR-cyklusser er relateret.For det andet kvaliteten og mængden af enzymer.Ofte er enzymer fra nogle kilder tilbøjelige til ikke-specielle bånd, og enzymerne fra den anden kilde forekommer ikke.Nogle gange forekommer også uspecifik amplifikation af enzymer.Modforanstaltningerne er: re-designede attraktive om nødvendigt.Reducer mængden af enzym eller udskift enzymet fra en anden kilde.Reducer mængden af primær, øg mængden af skabeloner passende, og reducer antallet af cyklusser.Øg udglødningstemperaturen korrekt, eller brug metoden med to temperaturpunkter (93°C degeneration, udglødning og forlængelse ved ca. 65°C).
● Vise flagende blår eller smørebånd
PCR-amplifikation ser nogle gange ud til at være påført eller afskallet eller tæppelignende bælte.Af grunden er dNTP-koncentrationen for høj, Mg2+-koncentrationen er for høj, annealingstemperaturen er for lav, og antallet af cyklusser er for høj på grund af den for store mængde enzymer eller den dårlige kvalitet af enzymet.Modforanstaltningerne er: ①Reducer mængden af enzymer, eller skift enzymet fra en anden kilde.②Reducer koncentrationen af dNTP ③Reducer Mg2+-koncentrationen korrekt.④Øg antallet af skabeloner og reducer antallet af cyklusser.
Relaterede produkter
◮ Højere troskab: 6 gange mere end almindeligt Taq-enzym;
◮ Hurtigere forstærkningshastighed
◮ Mere skabelontilpasning
◮ Højere forstærkningseffektivitet
◮ Miljøtolerancen er stærkere: placeres ved 37°C i en uge, opretholder mere end 90 % aktivitet;
◮ Det har 5'→3' DNA-polymeraseaktivitet og 5'→3' exonukleaseaktivitet uden 3'→5' exonukleaseaktivitet.
Det unikke reaktionssystem og højeffektive Taq DNA-polymerase gør, at PCR-reaktionen har højere amplifikationseffektivitet, specificitet og sensitivitet.
RT-qPCR Easyᵀᴹ (One Step)-SYBR Grøn I
◮ Et-trins kit gør omvendt transkription og qPCR til to reaktioner i samme rør, behøver kun at tilføje skabelon-RNA, specifikke PCR-primere og RNase-fri ddH2O.
◮ Sættet kan hurtigt og effektivt kvantitativt analysere viralt RNA eller spore RNA.
◮ Sættet bruger et unikt Foregene revers transkriptionsreagens og Foregene HotStar Taq DNA Polymerase kombineret med et unikt reaktionssystem for effektivt at forbedre amplifikationseffektiviteten og specificiteten af reaktionen.
◮ Det optimerede reaktionssystem gør, at reaktionen har højere detektionsfølsomhed, stærkere termisk stabilitet og bedre tolerance.
◮ RT-qPCR NemTM(One Step)-SYBR Green I kit leveres med ROX intern referencefarve, som kan bruges til at eliminere signalbaggrund og signalfejl mellem brønde, hvilket er praktisk for kunder at bruge i forskellige modeller af kvantitative PCR-instrumenter.
RT nemtTMII (Master Premix til førstestrengs cDNA-syntese tilRealtids PCR)
-Effektiv evne til at fjerne gDNA, som kan fjerne gDNA i skabelonen inden for 2 minutter.
-Effektivt omvendt transkriptionssystem, det tager kun 15 minutter at fuldføre syntesen af det første streng cDNA.
-Komplekse skabeloner: skabeloner med højt GC-indhold og kompleks sekundær struktur kan også vendes med høj effektivitet.
-Højfølsomt revers transkriptionssystem, pg-niveau skabeloner kan også få cDNA af høj kvalitet.
- Det omvendte transkriptionssystem har høj termisk stabilitet, den optimale reaktionstemperatur er 42 ℃, og det har stadig en god revers transkriptionsydelse ved 50 ℃.
Post tid: Mar-18-2023