Molekylær diagnoseteknologi bruger molekylærbiologiske metoder til at detektere ekspressionen og strukturen af det genetiske materiale i den menneskelige krop og forskellige patogener for at opnå formålet med at forudsige og diagnosticere sygdomme.
I de senere år, med opgraderingen og iterationen af molekylær diagnostisk teknologi, er den kliniske anvendelse af molekylær diagnostik blevet mere og mere omfattende og dybdegående, og markedet for molekylær diagnostik er gået ind i en periode med hurtig udvikling.
Forfatteren opsummerer de gængse molekylære diagnostiske teknologier på markedet, og er opdelt i tre dele: Den første del introducerer PCR-teknologien, den anden del introducerer nukleinsyrens isotermiske amplifikationsteknologi, og den anden del introducerer sekventeringsteknologien.
01
Del I: PCR-teknologi
PCR teknologi
PCR (polymerasekædereaktion) er en af in vitro DNA-amplifikationsteknologierne med en historie på mere end 30 år.
PCR-teknologien blev udviklet i 1983 af Kary Mullis fra Cetus, USA.Mullis ansøgte om et PCR-patent i 1985 og udgav det første PCR-akademiske papir om videnskab samme år.Mullis vandt Nobelprisen i kemi i 1993.
Grundlæggende principper for PCR
PCR kan amplificere mål-DNA-fragmenter mere end en million gange.Princippet er, at under katalyse af DNA-polymerase anvendes stamstrengs-DNA som skabelon, og en specifik primer bruges som udgangspunkt for forlængelse.Det replikeres in vitro gennem trin som denaturering, annealing og forlængelse.Processen med datterstrengs-DNA, der er komplementær til stamstrengskabelon-DNA'et.
Standard PCR-processen er opdelt i tre trin:
1. Denaturering: Brug høj temperatur til at adskille DNA-dobbeltstrenge.Hydrogenbindingerne mellem DNA-dobbeltstrenge brydes ved høje temperaturer (93-98°C).
2. Annealing: Efter at det dobbeltstrengede DNA er adskilt, sænkes temperaturen, så primeren kan binde til det enkeltstrengede DNA.
3. Forlængelse: DNA-polymerasen begynder at syntetisere komplementære strenge langs DNA-strengene fra de bundne primere, når temperaturen sænkes.Når forlængelsen er afsluttet, afsluttes en cyklus, og antallet af DNA-fragmenter fordobles.
Ved at gentage disse tre trin 25-35 gange vil antallet af DNA-fragmenter stige eksponentielt.
Opfindsomheden ved PCR er, at forskellige primere kan designes til forskellige målgener, således at målgenfragmenterne kan amplificeres på kort tid.
Indtil videre kan PCR opdeles i tre kategorier, nemlig almindelig PCR, fluorescerende kvantitativ PCR og digital PCR.
Den første generation af almindelig PCR
Brug et almindeligt PCR-amplifikationsinstrument til at amplificere målgenet, og brug derefter agarosegelelektroforese til at påvise produktet, kun kvalitativ analyse kan udføres.
De vigtigste ulemper ved den første generation af PCR:
- Tilbøjelig til uspecifik amplifikation og falsk positive resultater.
-Detekteringen tager lang tid, og operationen er besværlig.
-Kun kvalitativ test kan udføres.
Anden generations fluorescens kvantitativ PCR
Fluorescens kvantitativ PCR (Real-Time PCR), også kendt som qPCR, bruges til at overvåge akkumulering af amplificerede produkter gennem akkumulering af fluorescerende signaler ved at tilføje fluorescerende prober, der kan indikere forløbet af reaktionssystemet, og til at bedømme resultaterne gennem fluorescenskurven, og det kan kvantificeres med standardkurveværdien og standardkurvens hjælp.
Fordi qPCR-teknologien udføres i et lukket system, reduceres sandsynligheden for kontaminering, og fluorescenssignalet kan overvåges for kvantitativ påvisning, så det er den mest udbredte i klinisk praksis og er blevet den dominerende teknologi inden for PCR.
De fluorescerende stoffer, der anvendes i real-time fluorescerende kvantitativ PCR, kan opdeles i: TaqMan fluorescerende prober, molekylære beacons og fluorescerende farvestoffer.
1) TaqMan fluorescerende sonde:
Under PCR-amplifikation tilføjes en specifik fluorescerende probe, mens der tilføjes et par primere.Proben er et oligonukleotid, og de to ender er henholdsvis mærket med en reporter-fluorescerende gruppe og en quencher-fluorescerende gruppe.
Når proben er intakt, absorberes det fluorescerende signal, der udsendes af reportergruppen, af quenching-gruppen;under PCR-amplifikation spalter og nedbryder 5'-3' exonukleaseaktiviteten af Taq-enzymet proben, hvilket gør reporteren til fluorescerende gruppe og quencher. Den fluorescerende gruppe adskilles, så fluorescensovervågningssystemet kan modtage fluorescenssignalet, dvs. hver gang en DNA-streng akkumuleres, fluorescerende forstærkes, fluorescerende og fluorescerende. cence-signalet er fuldstændig synkroniseret med dannelsen af PCR-produktet.
2) SYBR fluorescerende farvestoffer:
I PCR-reaktionssystemet tilsættes et overskud af SYBR fluorescerende farvestof.Efter at SYBR-fluorescerende farvestof er ikke-specifikt inkorporeret i DNA-dobbeltstrengen, udsender det et fluorescerende signal.SYBR-farvestofmolekylet, der ikke er inkorporeret i kæden, vil ikke udsende noget fluorescerende signal, hvilket sikrer det fluorescerende signal. Stigningen i PCR-produkter er fuldstændig synkroniseret med stigningen i PCR-produkter.SYBR binder kun til dobbeltstrenget DNA, så smeltekurven kan bruges til at bestemme, om PCR-reaktionen er specifik.
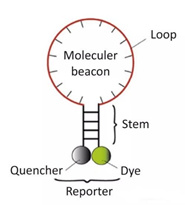
3) Molekylær beacons
Det er en stamløkke dobbeltmærket oligonukleotidprobe, der danner en hårnålestruktur på omkring 8 baser ved 5 og 3 enderne.Nukleinsyresekvenserne i begge ender er komplementært parrede, hvilket forårsager, at den fluorescerende gruppe og den quenchende gruppe er tætte.Luk, det vil ikke producere fluorescens.
Efter at PCR-produktet er genereret, under annealingsprocessen, parres den midterste del af det molekylære beacon med en specifik DNA-sekvens, og det fluorescerende gen adskilles fra quencher-genet for at producere fluorescens.
De største ulemper ved anden generation af PCR:
Følsomheden mangler stadig, og detektionen af prøver med lavt antal kopier er ikke nøjagtig.
Der er baggrundsværdipåvirkning, og resultatet er modtageligt for interferens.
Tredje generation digital PCR
Digital PCR (DigitalPCR, dPCR, Dig-PCR) beregner kopitallet for målsekvensen gennem endepunktsdetektion og kan udføre nøjagtig absolut kvantitativ detektion uden brug af interne kontroller og standardkurver.
Digital PCR bruger endepunktsdetektion og afhænger ikke af Ct-værdien (cyklustærskel), så den digitale PCR-reaktion er mindre påvirket af amplifikationseffektiviteten, og tolerancen over for PCR-reaktionshæmmere er forbedret med høj nøjagtighed og reproducerbarhed.
På grund af egenskaberne ved høj følsomhed og høj nøjagtighed forstyrres den ikke let af PCR-reaktionshæmmere, og den kan opnå ægte absolut kvantificering uden standardprodukter, som er blevet et forsknings- og anvendelseshotspot.
I henhold til reaktionsenhedens forskellige former kan den opdeles i tre typer: mikrofluidiske, chip- og dråbesystemer.
Indlægstid: Jul-08-2021