Verifikation af ydeevnen af primere og prober i det tidlige stadie af PCR-reagenser og bestemmelse af de bedst egnede reaktionsbetingelser er forudsætningerne for at sikre en jævn fremgang af formelle eksperimenter.
Så hvordan skal vi bekræfte primerproben i det tidlige stadie?
De vigtigste indikatorer er baseline, amplifikationskurve, ct-værdi, amplifikationseffektivitet, lavkoncentrationsprøvedetektion, CV osv.
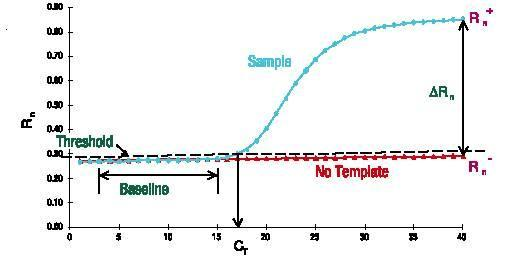
Baseline
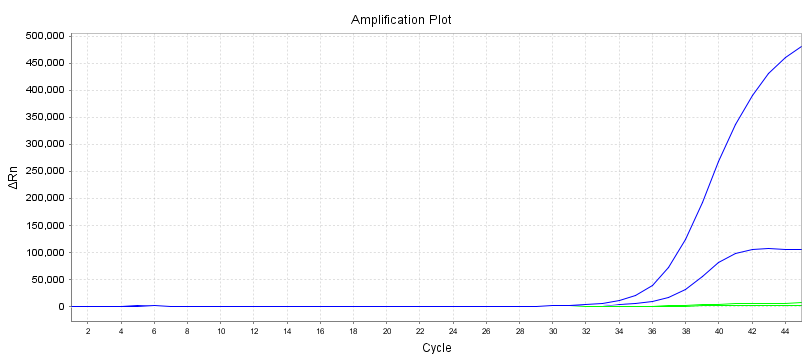
Basislinjen er den vandrette linje i PCR-amplifikationskurven.I de første par cykler af PCR-amplifikationsreaktionen ændres fluorescenssignalet ikke meget og danner en lige linje.Denne lige linje er basislinjen.
Når du screener PCR-primerprober, skal du være opmærksom på, om baseline er niveau.Renheden af primerprobekoncentrationen vil påvirke basislinjen, såsom at få basislinjen til at stige eller falde.Grundlinjen er også en meget intuitiv indikator.
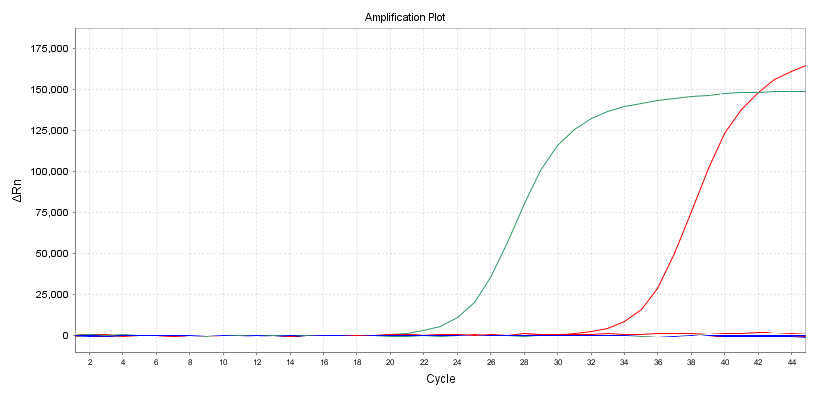
Amplifikationskurve
En anden intuitiv indikator er formen på forstærkningskurven.Det er bedst at have en S-formet kurve for at undgå sekundær amplifikation eller andre unormale amplifikationskurver.
Ct værdi
Antallet af cyklusser, der svarer til vendepunktet fra basislinjen til den eksponentielle vækst, er Ct-værdien.
For den samme prøve resulterer forskellige primerprober i forskellige amplifikationskurver, og den tilsvarende Ct-værdi vil blive påvirket af amplifikationseffektiviteten og interferensgraden.I teorien, jo mindre Ct-værdien af primerproben vi vælger, jo bedre.
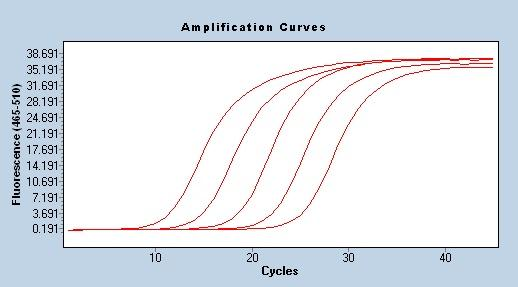
Forstærkningseffektivitet
En af de mest pålidelige og stabile metoder til evaluering af PCR-amplifikationseffektivitet er standardkurven, som også er bredt anerkendt af forskere.Metoden involverer at lave en række prøver for at kontrollere det relative antal målskabeloner.Disse prøver fremstilles normalt ved seriefortyndinger af koncentrerede stamopløsninger, den mest almindeligt anvendte er 10-folds fortynding.Ved at bruge en række fortyndede prøver, bruge standard qPCR-program til at amplificere for at opnå Cq-værdien, og til sidst tegne en standardkurve i henhold til koncentrationen af hver prøve og den tilsvarende Cq-værdi for at opnå den lineære ligning Cq= -klgX0+b, og amplifikationseffektiviteten E=10(-1 /k)-1.Ved brug af qPCR til kvantitativ analyse kræves det, at amplifikationseffektiviteten er i området 90%-110% (3,6>k>3,1).
Detektion af prøver med lav koncentration
Når prøvekoncentrationen er lav, er detektionshastighederne for forskellige primerprober forskellige.Vi udvælger 20 prøver med lav koncentration til at replikere, og primer-probe-systemet med den højeste detektionshastighed er det bedste.
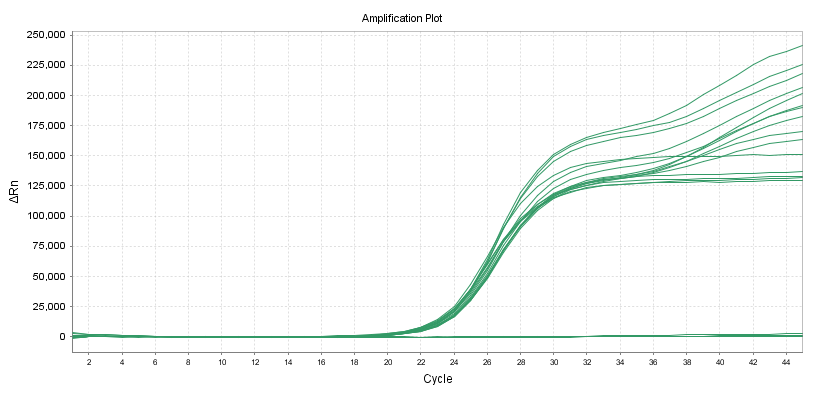
Variationskoefficient (CV)
10 duplikatprøver kan påvises med forskellige primerprober i henhold til linjestandarden for reagenset til nukleinsyreamplifikationsdetektion.
Kvantitative reagenser:
Nøjagtighed
Nøjagtigheden inden for en batch skal opfylde: variationskoefficienten (CV,%) af den logaritmiske værdi af testkoncentrationen er ≤5%.Når prøvekoncentrationen er lav, er variationskoefficienten (CV,%) af logaritmen af detektionskoncentrationen ≤10%
Kvalitative reagenser:
Nøjagtighed
Nøjagtigheden inden for en batch skal opfylde:
(1) Variationskoefficient for Ct-værdi (CV,%) ≤5%
Den samme prøve testes parallelt i 10 gange, og testresultaterne skal være konsistente
Indlægstid: 18. september 2021








